本文优先发表于“介入前线”微信公众号。欢迎交流、指教:
引言: 生活不止IPO和新产品上市,还有不良反应、并发症、集采、 召回 和撤市。健康所系,质量第一。让我们一起进入“2023年美国FDA发布的介入领域医疗器械召回事件汇总系列”的第一弹,防微杜渐吧。本弹汇总了2023上半年介入(含血管与非血管)领域的相关情况。信息来源:美国FDA网站。
正文(按FDA发布日期先后顺序排序):
1. Datascope/Getinge公司:Cardiosave Hybrid及Cardiosave Rescue Intra-Aortic Balloon Pumps (IABP)
召回核心要点:
- FDA发布日期:2023年1月25日
- FDA对相关内容的最后更新日期:2023年1月25日
- 召回级别:I级
- 产品简介:Cardiosave Hybrid Intra-Aortic Balloon Pump(IABP)及Cardiosave Rescue IABP是放置于主动脉内可通过电机械系统控制进行充气/放气的球囊。用于支持左室功能。这两种IABP产品的适应证为对成年患者中应用于下列情况:ACS,心脏/非心脏手术,心衰并发症。
- 召回原因:IABP球囊质量问题:破裂;泄露;磨损。这会导致血液进入IABP系统。
- 产品销售时间范围:2012年3月6日至今
- 美国召回数量:4,454
- 公司召回起始日期:2022年12月29日
2. Datascope/Getinge公司:Cardiosave Hybrid及Cardiosave Rescue Intra-Aortic Balloon Pumps (IABP)
召回核心要点:
- FDA发布日期:2023年3月17日
- FDA对相关内容的最后更新日期:2023年3月17日
- 召回级别:I级
- 产品简介:产品简介:Cardiosave Hybrid Intra-Aortic Balloon Pump(IABP)及Cardiosave Rescue IABP是放置于主动脉内可通过电机械系统控制进行充气/放气的球囊。用于支持左室功能。这两种IABP产品的适应证为对成年患者中应用于下列情况:ACS,心脏/非心脏手术,心衰并发症。
- 召回原因:线圈故障,可能导致系统意外停机。
- 产品销售时间范围:2012年3月6日至2017年7月20日
- 美国召回数量:约2,300
- 公司召回起始日期:2023年1月9日
3. Datascope/Getinge公司:Cardiosave Hybrid及Cardiosave Rescue Intra-Aortic Balloon Pumps (IABP)(小编有话说:此处没有写重;此公司此产品截至2023年8月底的整体统计,有5次召回,因此本系列后续几弹中还会看到它。另外2022年发布的召回中,也有此产品。)
召回核心要点:
- FDA发布日期:2023年3月31日
- FDA对相关内容的最后更新日期:2023年3月31日
- 召回级别:I级
- 产品简介:Cardiosave Hybrid Intra-Aortic Balloon Pump(IABP)及Cardiosave Rescue IABP是放置于主动脉内可通过电机械系统控制进行充气/放气的球囊。用于左心室功能的支持。这两种IABP适应证为在成年患者中的下列情况:ACS,心脏/非心脏手术,心衰并发症。
- 召回原因:线路板间通信故障,可能导致系统意外停机。
- 产品销售时间范围:2012年3月6日至2023年1月13日
- 美国召回数量:约4,502
- 公司召回起始日期:2023年1月9日
4. Abiomed公司:Specific Impella 5.5 with SmartAssist
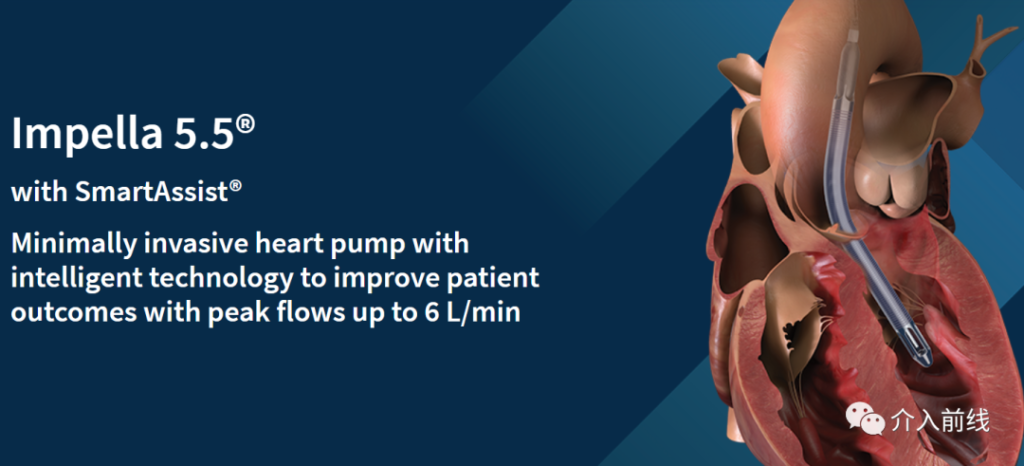
Impella 5.5 with SmartAssist
召回核心要点:
- FDA发布日期:2023年6月5日
- FDA对相关内容的最后更新日期:2023年6月5日
- 召回级别:I级
- 产品简介:Impella Left Sided Blood Pump用于高风险PCI术中的短时泵血支持。也可以用于:AMI后48小时内的持续性心源性休克,开放外科手术,心肌病致心功能异常。Impella系统通过减少心室做功及支持循环系统而发挥作用。
- 召回原因:接到清洗液泄露的客户投诉。清洗液泄露导致清洗压力降低,进而导致泵血功能完全失效。
- 产品销售时间范围:2021年9月28日至2023年3月6日
- 美国召回数量:466
- 公司召回起始日期:2023年4月17日




近期评论